2020 年全球获批上市的原创新药
2020 年,新型冠状病毒肺炎( COVID-19) 疫情( 以下简称为新冠疫情) 给人类生命健康和全球经济带来了巨大冲击,疫苗与新药研发成为公众关注的重大福祉问题,全球各国纷纷把生物医药产业放在突出地位。2020 年是生物医药领域获批新药成果丰硕的一年,这一年见证了曾获突破性疗法认定的靶向人滋养层细胞表面抗原 2 ( TROP-2) 的抗体药物偶联物( ADC) 及提高高致敏性的非活体器官移植成功率的药物的获批,提出了硼中子疗法和光免疫疗法等开创性的治疗理念,多种具有新颖机制的原创新药相继问世,为一些临床上无药可用的患者带来了新的希望。本文对 2020 年美国、欧盟、日本和我国获批上市的原创新药信息进行梳理和介绍,包括新分子实体( NME) 和新的治疗用生物制品( BLA) ,并展望了 2021 年生物医药领域新技术与新趋势,旨在为从事新药研发工作的人士提供参考。2020 年以前就已获批上市药物的相关仿制药、复方药、新增适应证、新剂型以及血液制品、中药等产品不在本文讨论范围。
1
2020 年美国 FDA 批准的全新药物
一直以来,美国原创新药的获批数量在全球高居榜首。在新冠疫情成为全球焦点的 2020 年,FDA在新冠肺炎创新疗法、检测试剂与疫苗方面加大了研发速度。在此方面,FDA 已经为多种与 COVID19 相关的检测手段和药物颁发了紧急使用授权( EUA) 。例如,2020 年 2 月 4 日,FDA 发 布 首 个EUA 产品“SARS-CoV-2 实时逆转录-聚合酶链反应( RT-PCR) 诊断面板”,用于确认新型冠状病毒病例[1]。5 月 1 日,FDA 紧急批准吉利德科学公司( Gilead Sciences Inc. ) 的抗病毒药物瑞德西韦( remdesivir) 静脉注射剂用于治疗 COVID-19,适用于因情况严重已经入院治疗的成人和儿童 COVID-19 疑似病例和确诊病例[2],10 月 22 日瑞德西韦获批正式上市。11 月 9 日,FDA 紧急批准礼来公司( EliLilly and Company) 的在研单克隆抗体( 单抗) 药物bamlanivimab,用于成人和儿童治疗轻度到中度COVID-19。11 月 21 日,FDA 紧急批准再生元制药公司( Regeneron Pharmaceuticals Inc. ) 的 2 种单抗 casirivimab 与 imdevimab 联合用药,用于成人及年龄为 12 岁及以上且体重至少达到 40 kg 的未成年人治疗轻中度 COVID-19[3]。
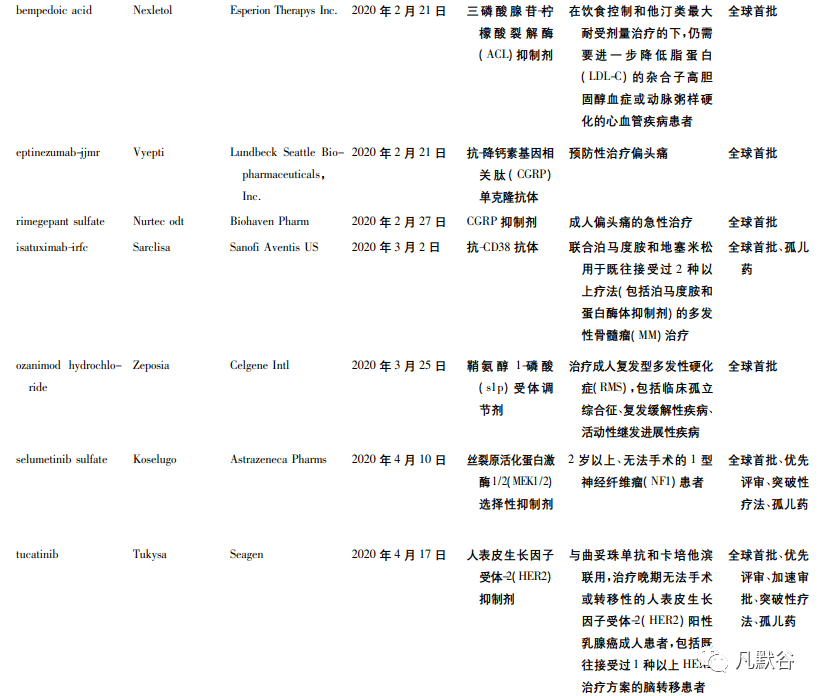
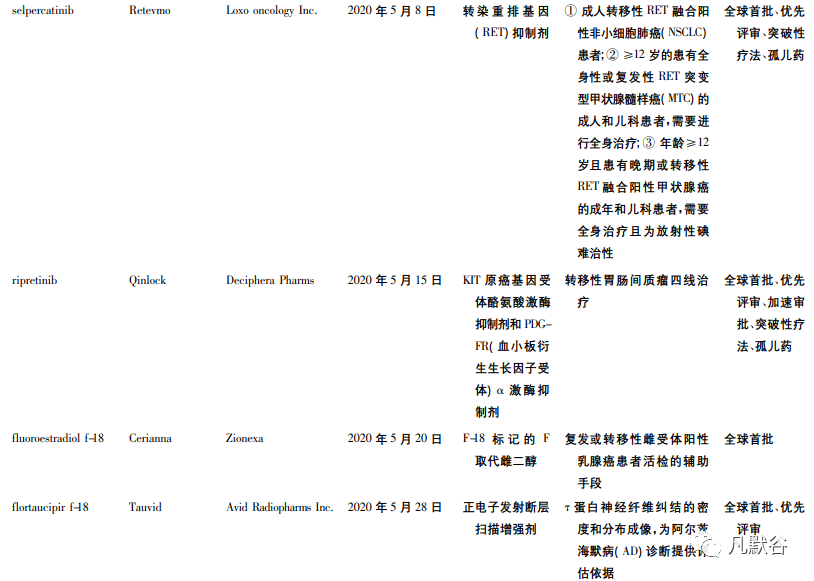
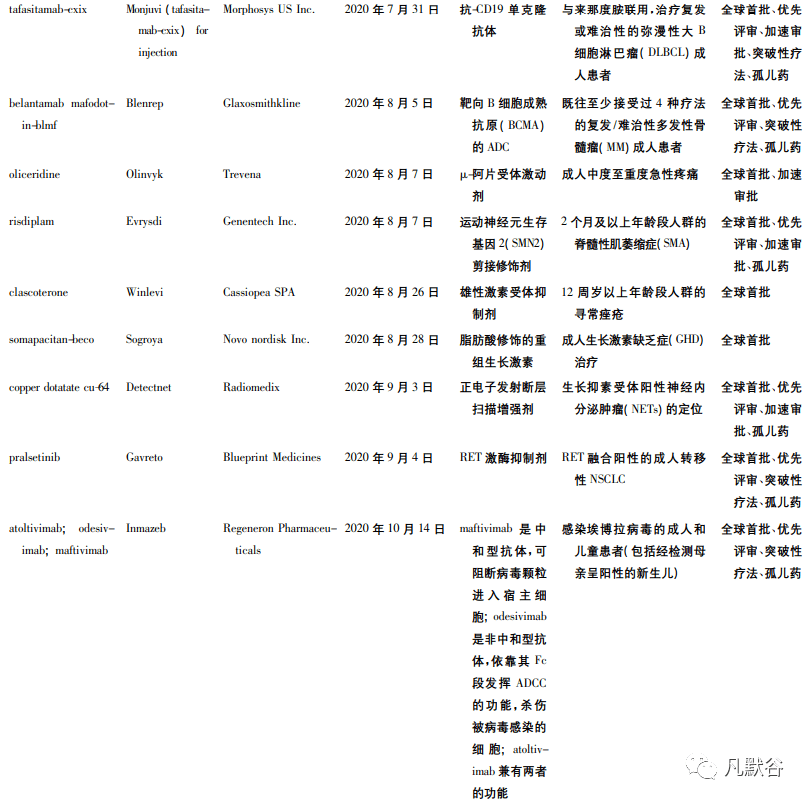
虽然受到新冠疫情的影响,但 FDA 在 2020 年度仍批准了多个原创新药上市。2020 年 FDA 批准的创新药数目多达 53 款,位列历史第 2 ( 2018年批准 59 款,为历史批准数量最高的一年) [4 - 5]。其中,40 个属于全球首次批准( 见表 1) ,38 个为小分子化学药,12 个为生物制品,2 个为 RNA 药物。这 53 款新药中有 22 个产品被认定为突破性疗法,31 个产品获得孤儿药认定,30 个产品获得优先审评。
从 FDA 批准的 53 个新药中,我们可以发现: 疾病领域方面,2020 年 FDA 批准的新药仍以抗肿瘤药居多,且大多获得突破性疗法认定。例如成纤维生长 因 子 ( FGF) 受 体 2 抑 制 剂 Pemazyre、靶 向TROP-2 的 ADC 药物 Trodelvy、MET 抑制剂 Tabrecta等。这些药物或能弥补临床上缺乏有效治疗手段的空白,或具有新颖的作用机制。
近年来,FDA 批准的新药中孤儿药占比均达到40% 左右,在 2018 年更是达到了 57%[6]。2020 年获得孤儿药资格的创新疗法获得批准的数目为 31个,占全年获批新药的 58. 5% ,从比例上看,达到了 5 年来占比的新高。孤儿药开发方兴未艾得益于 FDA 颁发的多种监管措施的激励,诸如市场独占期、政府资助、审评专家对研究方案的指导等[7],值得借鉴。获批孤儿药中不乏创新产品,例如 Astrazeneca pharms 公司研发的首款治疗 1 型神经纤维瘤病的药物疗法 Koselugo; Genentech 公司研发的治疗脊髓性肌萎缩症的首款口服创新药Evrysdi 等。
2020 年 FDA 批准的 53 款新药中,有 12 款为抗体药物,包括 2 款 ADC 药物 Trodelvy 和 Blenrep。值得一提的是,Horizon therapeutics ireland 公司研发的IGF-1R 抗体 Tepezza、Glaxosmithkline 公司研发的靶向 B 细胞成熟抗原( BCMA) 的 ADC 药物 Blenrep、Immunomedics 公司研发的靶向 Trop-2 的 ADC 药物Trodelvy 以及再生元制药公司研发的埃博拉抗体Inmazeb 均属于首创( first-in-class) 的抗体药物。与此同时,工程化抗体也明显增加,2 款 CD19 抗体Uplizna 和 Monjuvi ( tafasitamab-cxix) 、1 款 HER2 抗体 Tukysa 均是经过工程改造后得到的抗体药物。近 5 年来抗体药物的发展进入爆发阶段,单抗、双抗、ADC 等药物的快速崛起给生物医药行业增添了新的活力。




内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
2
2020 年欧盟批准的全新药物
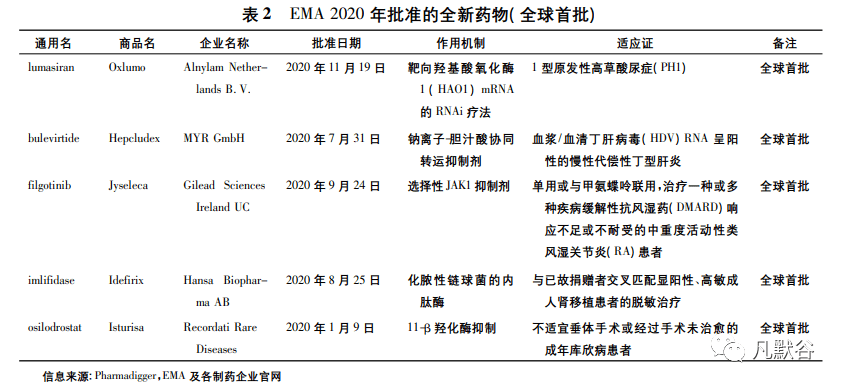
欧盟因成员国家众多,新药上市程序较为复杂等原因,新药审批速度不及美国,但欧盟的创新能力不容小觑,在全球亦占据着重要地位。EMA 在 2020年一共批准了 34 款新药,在众多新药中,有 6 个产品为全球首次批准( 见表 2) ,分别是: 1 型原发性高草酸尿症( PH1) 治疗药物 Oxlumo、血浆/血清丁肝病毒( HDV) RNA 呈阳性的慢性代偿性丁型肝炎治疗药物 Hepcludex,对抗风湿药( DMARD) 应答不足或不耐受的中重度活动性类风湿关节炎( RA) 治疗药物 Jyseleca,与已故捐赠者交叉匹配显阳性、高敏成人肾移植患者的脱敏治疗药物 Idefirix,不适宜垂体手术或经过手术未治愈的成年库欣病治疗药物Isturisa,用于治疗成人高胆固醇血症或混合性血脂异常药物 Leqvio。其中最值得关注的产品为 Idefirix,其由 Hansa Biopharma AB 公司研发,是一种化脓性链球菌的内肽酶,对人具有特异性,可迅速清除免疫球蛋白( IgG) ,提高移植的成功率[8]。该产品的上市将为高致敏性的非活体器官移植提供可能,是肾移植领域的一大突破性进展。
3
2020 年日本批准的全新药物
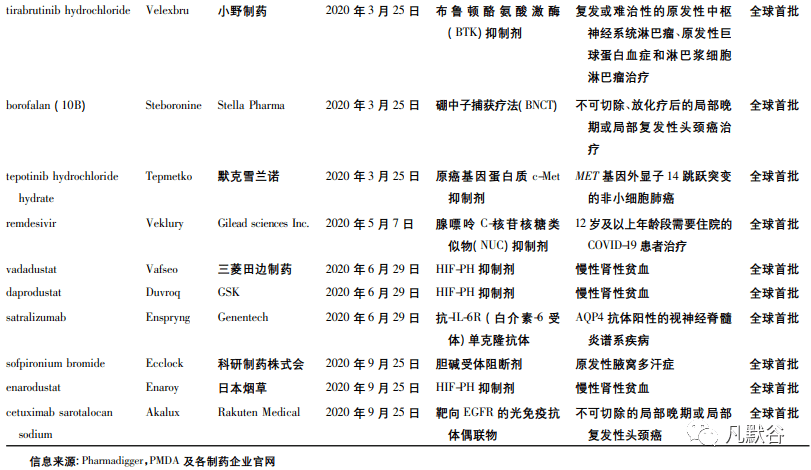
2020 年日本在新药审批方面成绩不菲。PMDA在 2020 年一共批准了 38 款新药,其中全球首次批准的产品有 13 个( 见表 3) 。虽然日本批准的新药数量不及 FDA,但一些产品非常值得期待。例如由Stella Pharma 公司研发的 steboronine,是一种硼中子捕获疗法( BNCT) ,用于治疗不可切除、放化疗后的局部晚期或局部 复发性头颈癌; Akalux 为 靶 向EGFR 的光免疫抗体偶联物,由 Rakuten Medical 公司研发,用于治疗不可切除的局部晚期或局部复发性头颈癌。硼中子疗法和光免疫疗法均为开创性的新治疗理念,将为原创新药的未来提供新的思路和方向。除此之外,PMDA 在 2020 年率先批准了 3 个缺氧诱导因子脯氨酰羟化酶( HIF-PH) 抑制剂,分别是: 三菱田边制药公司研发的 Vafseo、GSK 公司研发的 Duvroq、日本烟草公司研发的 Enaroy。这些新产品有望在未来引起慢性肾病( CKD) 贫血治疗趋势的转变,为慢性肾病贫血患者带来福音。还值得一提的是,由日本新药株式会社( Nippon shinyaku) 研发的治疗杜氏肌营养不良症( DMD) 的反义寡核苷酸疗法 Viltepso 是第一个也是唯一被证实在年龄低至 4 岁的儿童中可增加抗肌萎缩蛋白水平的第 53号外显子跳过疗法。
4
2020 年中国批准的全新药物
近年来,随着我国创新药相关政策的不断完善,新药研发氛围愈发活跃。2020 年,国家药品监督管理局( NMPA) 批准了 48 款新药,其中 9 个产品为本土企业研发且此前未曾在美欧日等国家或地区上市,见表 4。从表中可以看出,我国的创新药主要集中在抗肿瘤领域,9 个产品中抗肿瘤药物有 5 个,主要为替尼类( 4 个) 。替尼类药物引领肿瘤治疗进入靶向治疗时代,其不仅可有效延长肿瘤患者的生存期,还能大幅提高患者生活质量,是国内企业争相布局的领域之一。在传染性疾病防治领域值得一提的是,我国在新冠疫苗的研发中取得了骄人的成绩,截至 2021 年 3 月 20 日,我国已有 4 款自主研发的新冠疫苗获批上市,包括 3 种灭活疫苗,1 种腺病毒载体疫苗。与此同时,我国积极为世界其他国家提供新冠疫苗援助,为构建人类卫生健康共同体做出了巨大贡献,充分彰显了中国速度和大国担当。


5
2021 年生物医药领域展望
随着后疫情时代的到来,生物医药行业的发展趋势引发业内人员热切关注。2020 年 7 月 16 日,EvaluatePharma 发 布 了 题 为“World Preview 2020,Outlook to 2026”的预测报告,报告指出,未来几年,肿瘤领域仍是领先的研发投资领域,预计 2026 年全球研发支出将达到 820 亿美元,是其他任何领域的3 倍以上。孤儿药市场的销售额预计将从 2019 年的1 270 亿美元翻 1 倍,到 2026 年达到 2 550 亿美元,预计 2020—2026 年的复合年增长率为 10. 8%[9]。
同年 12 月 7 日,eHEALTH 网站发布了一篇题为“Five Trends to Watch Out for in the Parma Industryin 2021”的文章,报道了 2021 年医药行业值得注意的五大趋势。文章指出,2021 年药物从发现到上市的时间将会更快; 数字化和自动化程度将进一步提高; 在合规和监管方面的全球合作将进一步加强; 生物制品( biologics) 将成为新药研发的主要方向,同时有研究预测遗传学将在医药行业发展的进程中产生数量最多的新研究和成果; 随着连接设备、可穿戴设备和物联网( IOT) 的出现,自我监测的新趋势将逐渐形成。预计 2021 年,人工智能( AI) 初诊专家终审的模式也将逐渐成为一种新的常态[10]。展望2021,综合生物医药行业的发展趋势来看,NME,ADC,mRNA,siRNA 及肿瘤疫苗、CAR-T、溶瘤病毒、外泌体、基因疗法等都在快速发展,这些新的技术、新的治疗理念、新的药物将给生物医药行业未来的发展带来无限可能。
6





